ChiroBlocks IP-Factory
ChiroBlocks IP-Factory Nichtnatürliche Beta(2) Aminosäuren: Ein Beispiel aus ChiroBlocks eigenen Syntheseentwicklungen
Nichtnatürliche und seltene Aminosäuren sind oftmals Bestandteil von komplexeren Molekülen mit besonderen biologischen Eigenschaften. Das trifft zum einen für natürliche Verbindungen wie die Cryptophycine oder das fungizide Cispentacin zu, zum anderen aber auch für synthetische Substanzen wie etwa peptidische und nicht-peptidische Leitstrukturen biologischer Rezeptoren.
Trotz sehr intensiver Forschung an beta-Aminosäuren, bleibt speziell die Synthese und gezielte Anwendung von beta(2) Aminosäuren eine Herausforderung sowohl für Chemiker als auch für Biologen und Biochemiker.
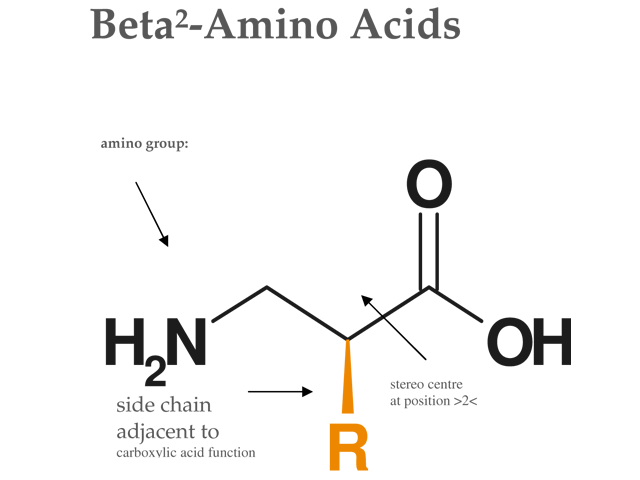
Struktur Beta 2 Aminosäuren
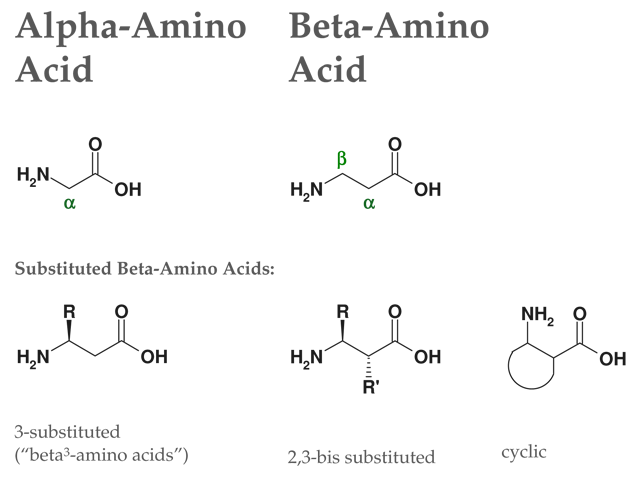
Struktur Beta 2 Aminosäuren 2
➤ Potential / aktuelle Anwendungen von Beta(2) - Aminosäuren:
Der Einbau von Beta-Aminosäuren in Peptide
- induziert stabile Sekundärstrukturen und
- erhöht die metabolische Stabilität dramatisch.
Die Beta-Aminosäure-Grundstruktur findet sich in vielen hochaktiven Naturstoffen wieder, zum Beispiel in
- beta-Lactam Antibiotika,
- Cancerostatica (z.B. Cryptophycine) und
- psychotropen Substanzen (z.B. D-Lysergic Acid).
Protein Kinase B inhibitor
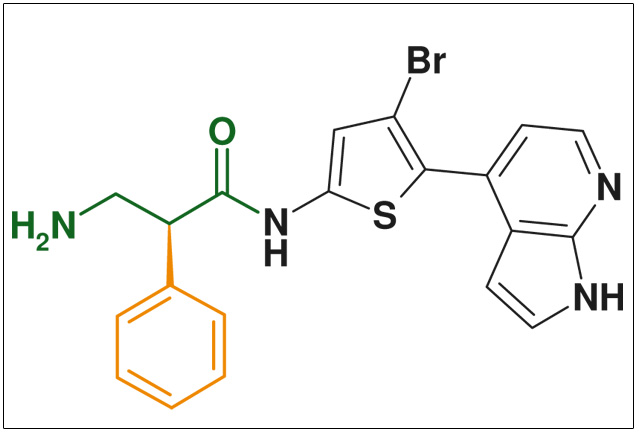
Abb: protein kinase B inhibitor (cancer & arthritis) WO 2007 076423 (Glaxo Smithkline)
Die kommerzielle Verfügbarkeit von Beta-Aminosäuren als chirale Synthesebausteine führte zur Entwicklung einer Vielzahl
- von pharmazeutisch aktiven Verbindungen und
- damit potentiellen Arzneiwirkstoffen.
In diesem Zusammenhang stellt insbesondere die Entwicklung stereoselektiver und wirtschaftlich effizienter Synthesen zu beta(2) – Aminosäuren eine bleibende Herausforderung dar. Das gilt umso mehr als diese deutlich schwieriger zugänglich sind als deren an der 3-Position verzweigten Analoga.
Während eine ganze Reihe diastereoselektiver Zugänge bekannt sind, wurde nur selten über die effizientere und wünschenswerte enantioselektiv katalysierte Synthese berichtet.
Anknüpfend an die vorhandenen Erfahrungen zu Michael – Additionen von Organometall-Verbindungen an Nitro-Acrylate, erweiterten wir diesen Ansatz auf:
- Aluminiumorganyle, die industriell produziert und daher gut verfügbar sind
- Zinkorganyle, welche zwar im Vergleich zu den Aluminiumverbindungen teurer sind, aber deutlich selektiver und atomeffizienter reagieren
- Borsäurederivate, die das Spektrum dieser Reaktion auf zahlreiche aromatische, heteroaromatische und funktionalisierte Seitenketten in der 2-Position erweitern
➤ Synthese: Asymmetrische Michael-Addition
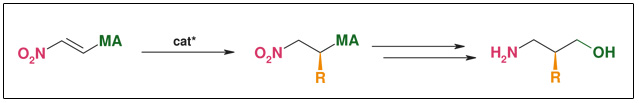
Abb. Asymmetrische Micheal Addition
- Auch für gamma-Aminoalkohole anwendbar
- Ein Substrat für viele Verbindungen
- Stereoselektive C-C-Knüpfung
- R weit variierbar
- Beide Enantiomere zu gleichen Kosten zugänglich
- Katalytisch (bis zu 0.1 mol%)
- Substrat & Katalysator gut verfügbar
- Ee: >98 %
- Skalierbar (wässrige Bedingungen, Raumtemperatur, kein Schutzgas)
Diese Reaktionen gestatten bereits den Zugang zu dutzenden verschiedenartig substituierten beta(2) Aminosäuren in definierter Stereo-Konfiguration. Durch alternative Synthesekonzepte konnte das Produktspektrum aber zusätzlich erweitert werden. So sind z.B. Verbindungen mit sehr empfindlichen funktionellen Gruppen durch enzymatische Racemattrennung erhältlich:
➤ Synthese: Enzymatische Racematspaltung
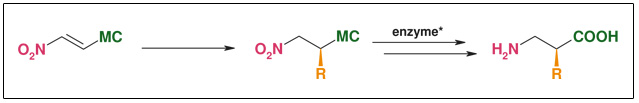
Abb: Enzymatische Racematspaltung
- Katalytische Einführung der Seitenketten
- Ein Substrat für viele Verbindungen
- R weit variierbar
- Hocheffiziente Auftrennung racemischer Mischungen
- Beide Enantiomere verfügbar
- Robustes und billiges Enzymsystem, toleriert sehr viele Substrate
- Ee: >98 %
- wässrige Bedingungen, Raumtemperatur, kein Schutzgas
Andere Substanzen, speziell solche mit benzylischen Seitenketten, können durch asymmetrische Hydrierung mittels homogener Katalysatoren erhalten werden:
➤ Synthese: Asymmetrische Hydrierung
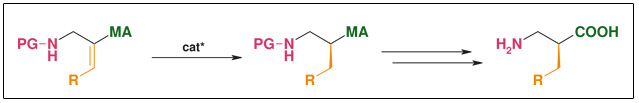
Abb.: Asymmetrische Hydrierung
- Hocheffiziente asymmetrische Hydrierung
- Gut verfügbarer Katalysator
- Einfache Substratsynthese
- R weit variierbar
- Katalytisch (bis zu 0.1 mol%)
- Beide Enantiomere zu gleichen Kosten zugänglich
- Ee: >98 %
- Skalierbar (Niederdruckhydrierung, einfache Standard-Reaktionen)
Im Ergebnis der mehr als zehn Jahre F&E an dieser Substanzklasse stellt ChiroBlock heute nicht nur eine breite Palette an konkreten Zielverbindungen bereit.
Wir bieten darüber hinaus auch kundenspezifische Adaptionen der Synthesen sowie spezielle Aminosäure-Bausteine als ‚advanced intermediates’ an.
➤ ChiroBlocks Angebot
Nichtexklusive Substanzen
- Pharmakologisch interessante Seitenketten >R<
- Auf Wunsch N-geschützt
- Forschungsmengen direkt ab Lager
- Bis zu kg Mengen direkt von ChiroBlock
Know-how / IP
- Kunden-spezifische Seitenketten >R< (exklusiv)
- Kleine Substanzbibliotheken möglich (exklusiv)
- IP-Transfer
ChiroBlock: Eine erste Adresse für all jene, die beta(2) – Aminosäuren suchen.
Mehr über andere interne Forschungsprojekte